重磅阿爾茨海默藥在華獲批!國內(nèi)還有哪些新藥在路上?
20年來首個(gè)獲得美國食品藥品監(jiān)督管理局(FDA)完全批準(zhǔn)的阿爾茨海默病藥物在中國也獲批了!
1月9日,衛(wèi)材中國宣布,侖卡奈單抗(中文商品名:樂意保)已在中國獲批,用于治療由阿爾茨海默病(AD)引起的輕度認(rèn)知障礙和阿爾茨海默病輕度癡呆。
此前有報(bào)道稱,侖卡奈單抗在美國的年治療費(fèi)用在2.65萬美元。目前,衛(wèi)材官方并未透露該藥在中國的價(jià)格。不過,該藥在2023年10月曾落地海南博鰲樂城國際醫(yī)療旅游先行區(qū),當(dāng)時(shí)披露的價(jià)格為3328.2元/瓶。
侖卡奈單抗獲批,禮來或承壓
阿爾茨海默病(AD)被稱為“毀滅性疾病”,患者的思維、記憶和獨(dú)立性會(huì)受損,有人形容患者的大腦放入了橡皮擦,不僅影響生活質(zhì)量,甚至導(dǎo)致死亡。AD的發(fā)病機(jī)制并不明確,目前業(yè)內(nèi)認(rèn)可的機(jī)制包括β淀粉樣蛋白(Aβ)異常沉積、Tau蛋白磷酸化、膽堿能損傷等假說,而Aβ的生成和清除失衡被普遍認(rèn)為與阿爾茨海默病進(jìn)展相關(guān),也成為相關(guān)藥物研發(fā)的一大方向。
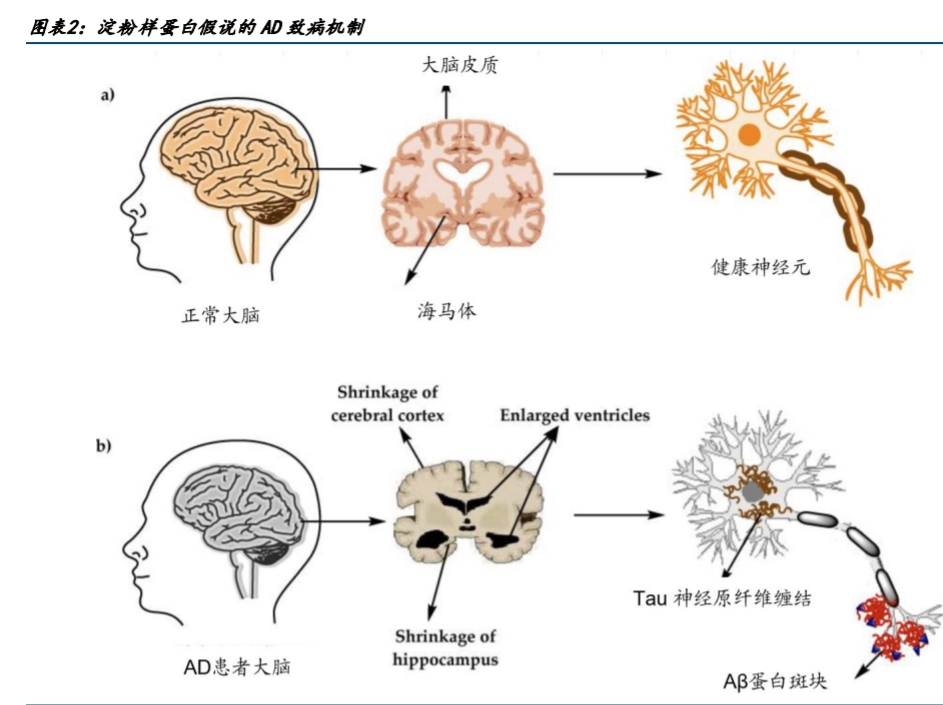
侖卡奈單抗是一款人源化抗可溶性Aβ單克隆抗體,于2023年7月在美國獲得完全批準(zhǔn)用于治療AD,該藥是20年來首個(gè)獲得FDA完全批準(zhǔn)的AD藥物。2023年9月,該藥在日本獲得批準(zhǔn),中國是第三個(gè)批準(zhǔn)侖卡奈單抗上市的國家。在中國,衛(wèi)材于2022年10月提交侖卡奈單抗的上市申請。2023年2月,衛(wèi)材中國宣布,該藥被納入優(yōu)先審評(píng)和批準(zhǔn)程序。
衛(wèi)材中國稱,侖卡奈單抗是第一種也是目前唯一完全獲批的能通過這一作用機(jī)制延緩疾病進(jìn)展、降低認(rèn)知和功能衰退速度的療法。
侖卡奈單抗的全球開發(fā)和監(jiān)管提交由衛(wèi)材主導(dǎo),產(chǎn)品則由衛(wèi)材和渤健共同商業(yè)化和推廣,其中衛(wèi)材擁有最終決策權(quán)。衛(wèi)材將在中國銷售該產(chǎn)品,并通過專業(yè)MR(醫(yī)藥代表)開展信息提供活動(dòng)。
同樣是跨國藥企的禮來也在推動(dòng)其AD新藥Donanemab在中國的獲批,該藥也屬于抗Aβ單抗。2023年11月14日,國家藥品監(jiān)督管理局藥品審評(píng)中心(CDE)官網(wǎng)公示,Donanemab注射液新藥上市申請擬納入優(yōu)先審評(píng)。如今衛(wèi)材/渤健的同款藥已先一步獲批,在大熱的AD領(lǐng)域,禮來或面臨競爭壓力。
國內(nèi)還有哪些阿爾茨海默病藥?上游診斷或受益
銀河證券研報(bào)2023年11月發(fā)布的一份研報(bào)指出,2022年我國60歲以上人口超2.8億,該群體認(rèn)知障礙患病率約為6.04%,其中AD占比約60%至80%,對應(yīng)患者人數(shù)1000萬至1400萬人,并隨著人口老齡化加深呈逐年增長態(tài)勢。
作為一種不可逆的神經(jīng)退行性疾病,目前AD在臨床上主要采取對癥治療。2023年12月,丹麥的靈北公司曾宣布,易倍申(鹽酸美金剛片)在中國的適應(yīng)證進(jìn)一步擴(kuò)展,適應(yīng)證范圍由原來的治療中重度至重度阿爾茨海默型癡呆擴(kuò)展為治療中度至重度阿爾茨海默型癡呆。該藥可以幫患者改善日常生活能力減退,精神行為異常以及認(rèn)知功能障礙三類癥狀,延緩臨床惡化。
此外,綠谷制藥的甘露特鈉膠囊(商品名:九期一)2019年在國內(nèi)獲批用于AD治療,綠谷制藥方面稱,該藥是全球首個(gè)靶向腦腸軸的抗AD寡糖藥物。2021年底,該藥通過醫(yī)保談判進(jìn)入國家醫(yī)保目錄,每盒價(jià)格由895元降至296元。不過,甘露特鈉膠囊獲批之后一直面臨著爭議。
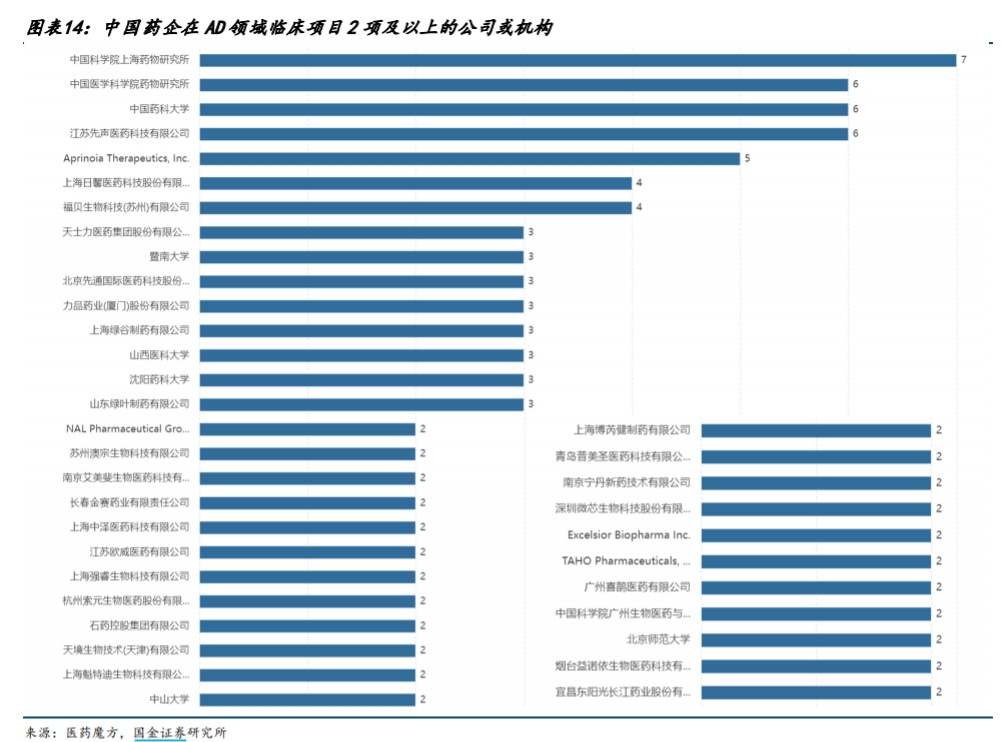
據(jù)銀河證券研報(bào),國內(nèi)臨床期AD新藥共有34款。國金證券研報(bào)則指出,中國參與AD研發(fā)的藥企眾多,生物藥與化藥方面都有值得關(guān)注的藥企。
通化金馬在布局的是一種新的乙酰膽堿酯酶抑制劑,該藥用于治療輕中度AD。2023年9月,通化金馬曾公告稱,全資子公司長春華洋高科技有限公司自主研發(fā)的琥珀八氫氨吖啶片項(xiàng)目取得重大研究進(jìn)展。該項(xiàng)目經(jīng)過雙盲、雙模擬、隨機(jī)、安慰劑/陽性平行對照三期臨床試驗(yàn),日前已完成三期揭盲和主要數(shù)據(jù)的統(tǒng)計(jì)分析。
或受上述進(jìn)展消息提振,通化金馬股價(jià)暴漲,成為當(dāng)時(shí)的“妖股”。根據(jù)2023年12月5日發(fā)布“股票交易異常波動(dòng)”公告中提到,琥珀八氫氨吖啶片三期臨床試驗(yàn)揭盲后,已進(jìn)入統(tǒng)計(jì)報(bào)告、臨床研究總結(jié)報(bào)告及新藥注冊申請資料撰寫階段。
目前,國內(nèi)也有不少藥企在圍繞Aβ機(jī)制進(jìn)行藥物研發(fā),不過大都處于早期研究階段。
2022年2月,先聲藥業(yè)(2096.HK)公告,其在研口服小分子藥物SIM0408的臨床試驗(yàn)申請獲藥監(jiān)局批準(zhǔn),用于治療AD導(dǎo)致的輕度認(rèn)知障礙或輕度癡呆。這款口服藥是2021年6月先聲藥業(yè)從Vivoryon獲取的,這項(xiàng)超5億美元的合作,讓先聲藥業(yè)獲得該藥在大中華區(qū)開發(fā)和商業(yè)化包括SIM0408在內(nèi)的2款針對具有神經(jīng)毒性的淀粉樣蛋白N3pE (pGlu-Abeta) AD治療藥物的權(quán)益。
2023年3月,恒瑞醫(yī)藥(600276)曾宣布,子公司上海恒瑞醫(yī)藥有限公司自主研發(fā)的抗Aβ單克隆抗體SHR-1707注射液用于治療早期AD的Ib期臨床試驗(yàn)在中國科學(xué)技術(shù)大學(xué)附屬第一醫(yī)院完成了首例患者入組及給藥。2023年7月,該藥的最新研究進(jìn)展還曾亮相阿爾茨海默病協(xié)會(huì)國際會(huì)議。
除了研發(fā)生產(chǎn)藥物的企業(yè),AD藥物的上游診斷行業(yè)同樣值得關(guān)注。國金證券研報(bào)指出,難癥重地,診斷先行,疾病認(rèn)識(shí)進(jìn)步與新藥突破,將推動(dòng)相關(guān)診斷賽道提速增長。目前中國AD診斷賽道參與廠商數(shù)量較少,主要集中在新興技術(shù)研究方向,診斷有望伴隨藥物放量迎來銷售機(jī)會(huì)。
銀河證券研報(bào)指出,AD診斷主要手段包括認(rèn)知評(píng)估:重要早期判別手段,但主觀性相對較強(qiáng);神經(jīng)影像學(xué):主要技術(shù)手段包括CT、MRl等,可用于區(qū)分癡呆類型及輔助評(píng)估AD病程;體外診斷:血液和腦脊液體外診斷主要樣本(可靠測量生物標(biāo)志物主要是Aβ/P-Tau/NfL/GFAP),但分別面臨采樣難、豐度低問題,質(zhì)譜法/單分子免疫檢測或?yàn)楦鼉?yōu)解,目前高端診斷試劑市場格局良好。
